CDMO
- CDMO 서비스 개요 (Source: 대신증권)
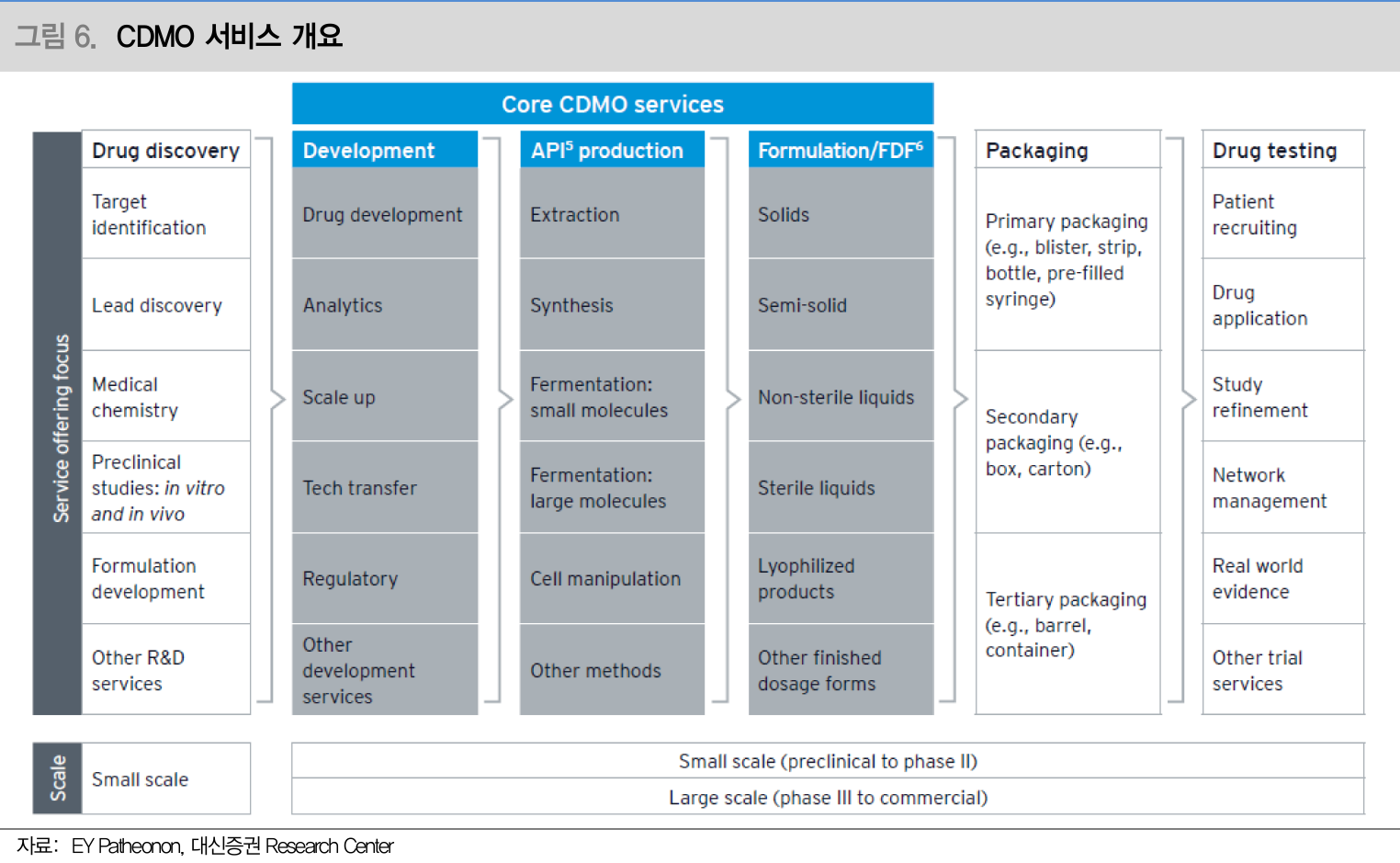
CDMO 구분
화학합성 CDMO
세포배양 CDMO
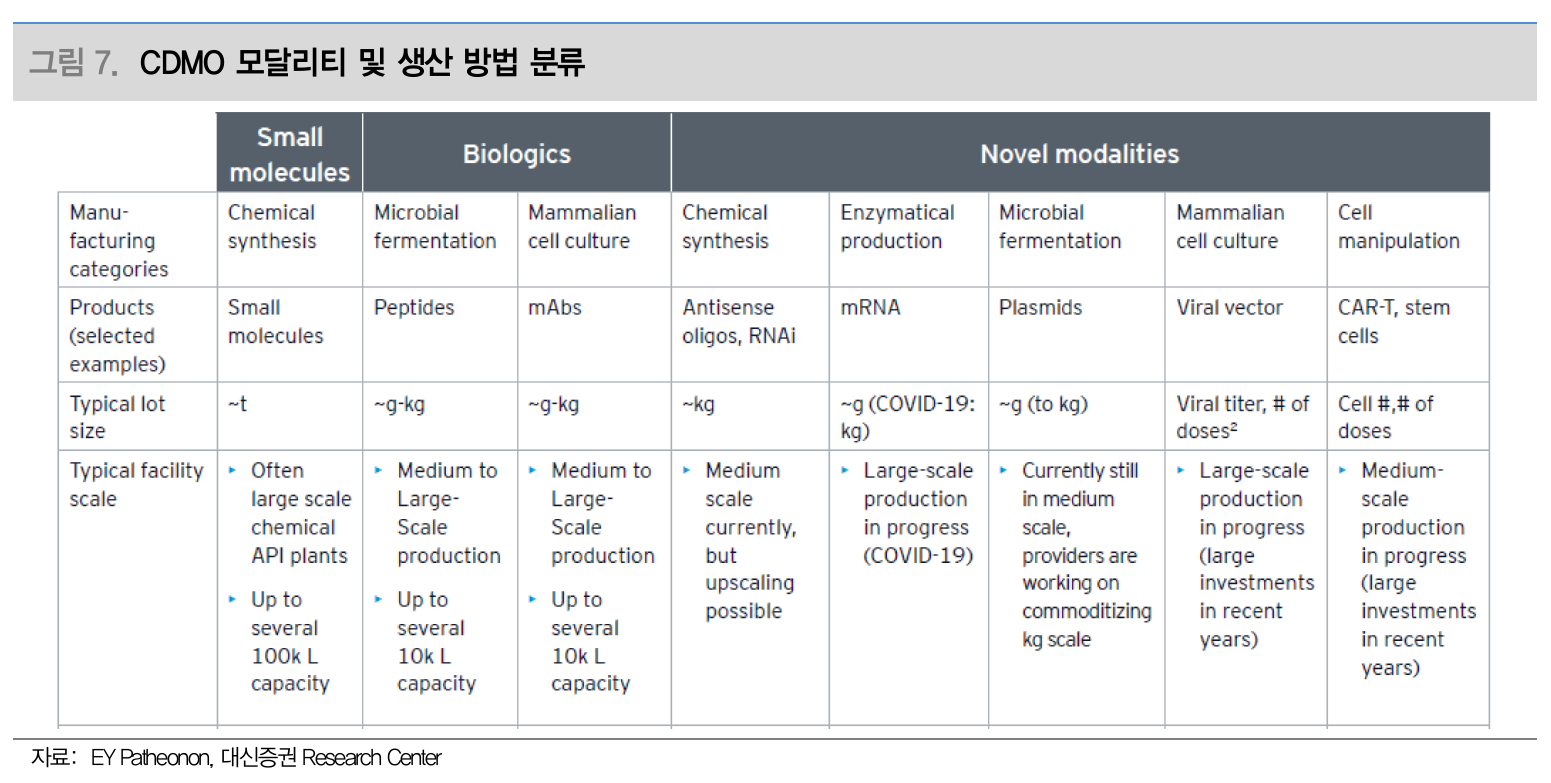
CDMO 모달리티 및 생산 방법 분류 (Source: 대신증권)
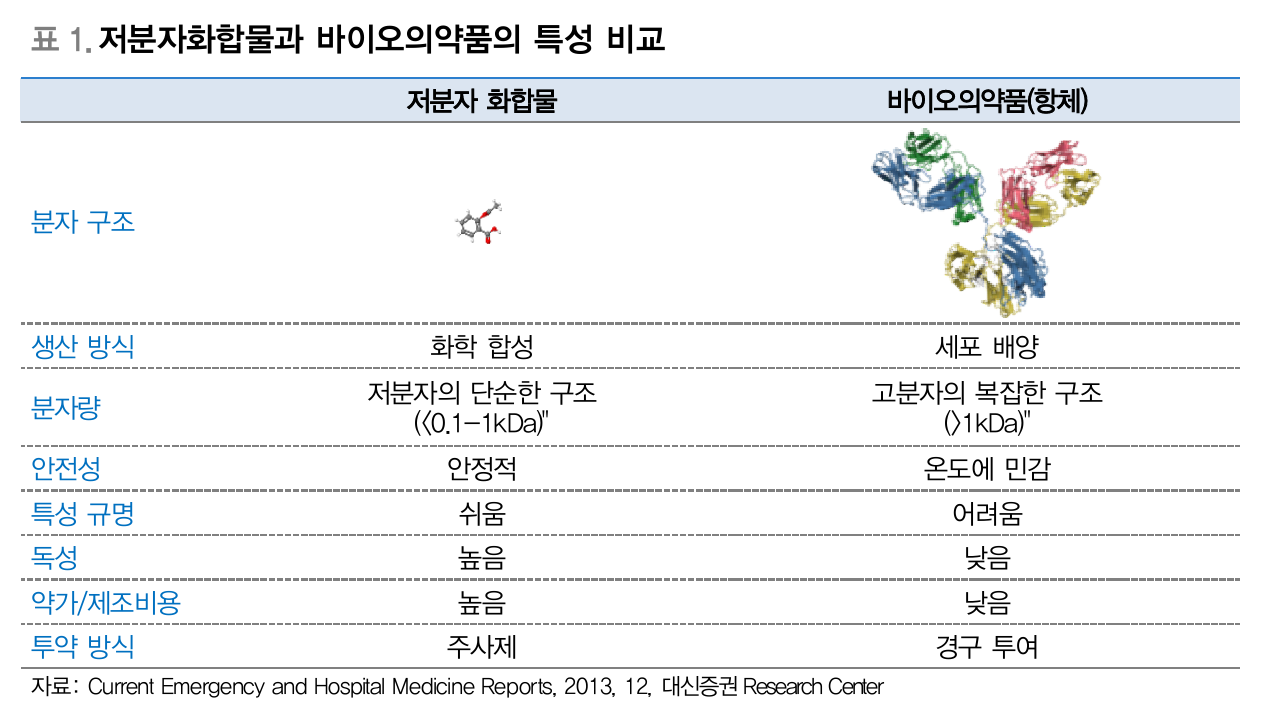
- 저분자화합물과 바이오의약품의 특성 비교 (Source: 대신증권)
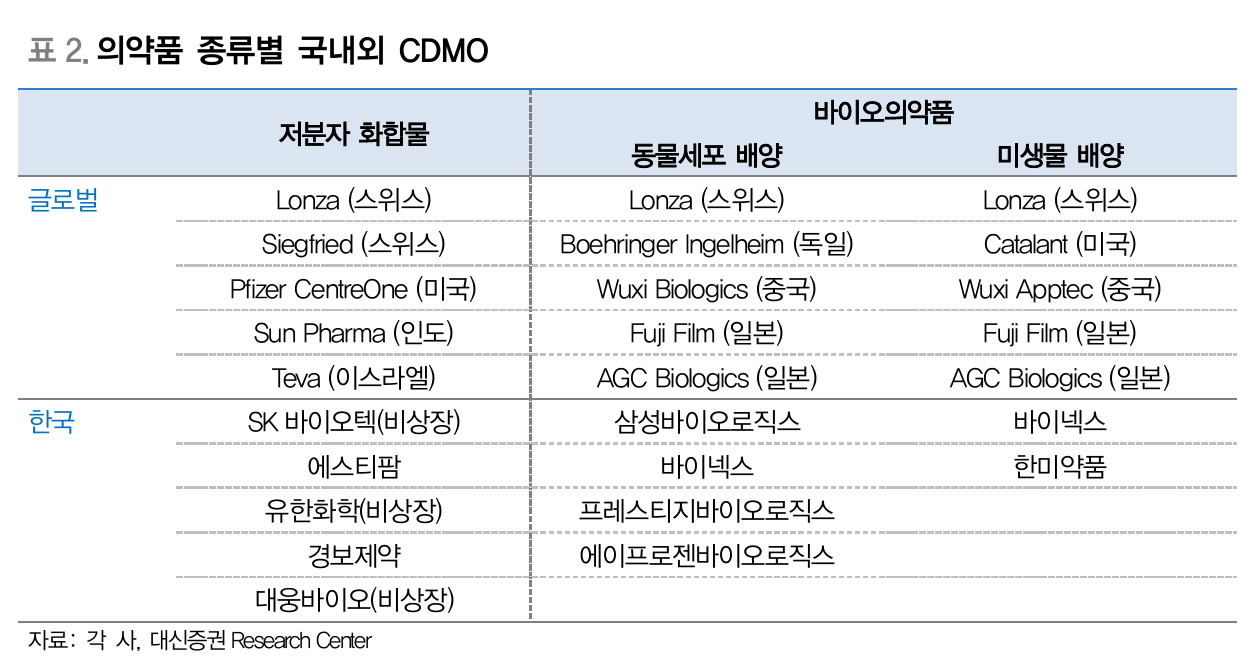
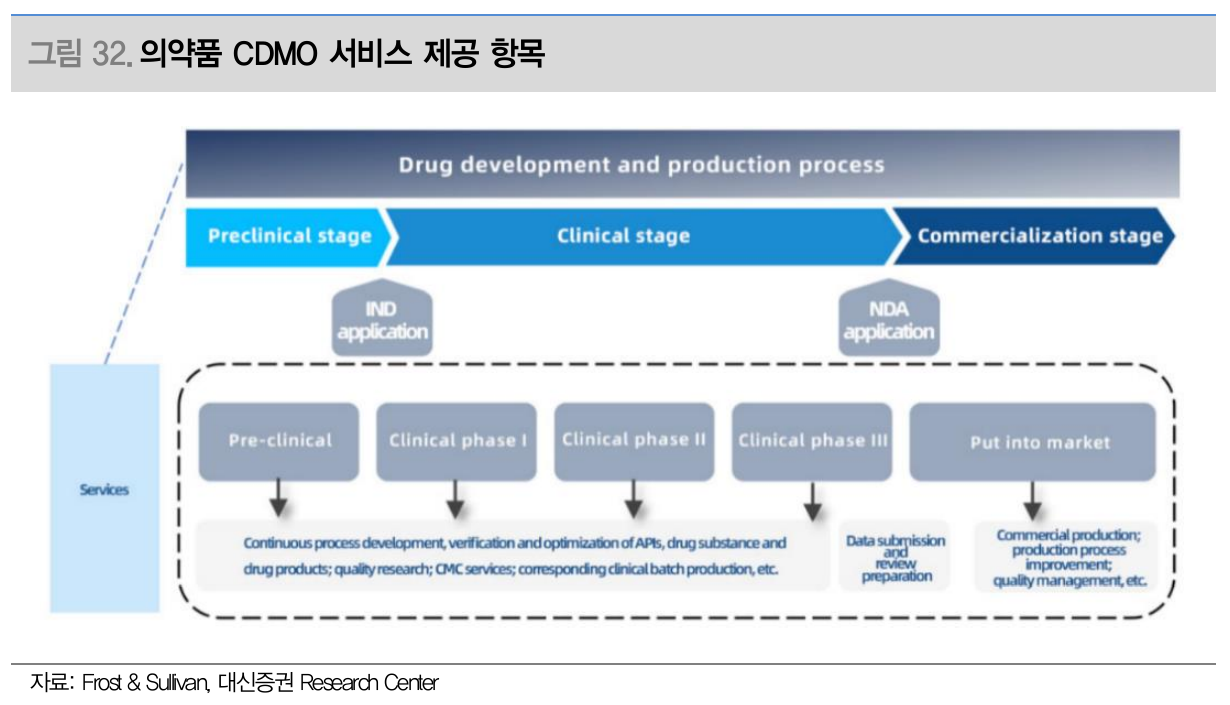
- 의약품 종류별 국내외 CDMO (Source: 대신증권)
화학합성
저분자 의약품, RNA, 펩타이드
분자량 적은 약물 생산
제조공정이 확립되면 일관된 생산 가능
화합물 순도를 높이기 위한 정제와 결정화 과정만 거치면 생산 끝남
- 복잡한 장비나 무균 환경 필요 없음
바이오 의약품 생산 시설에 비해 운영 및 관리 비용이 상대적으로 저렴 - 경제성 좋음
화학 합성 의약품 생산 공정 (Source: 대신증권)
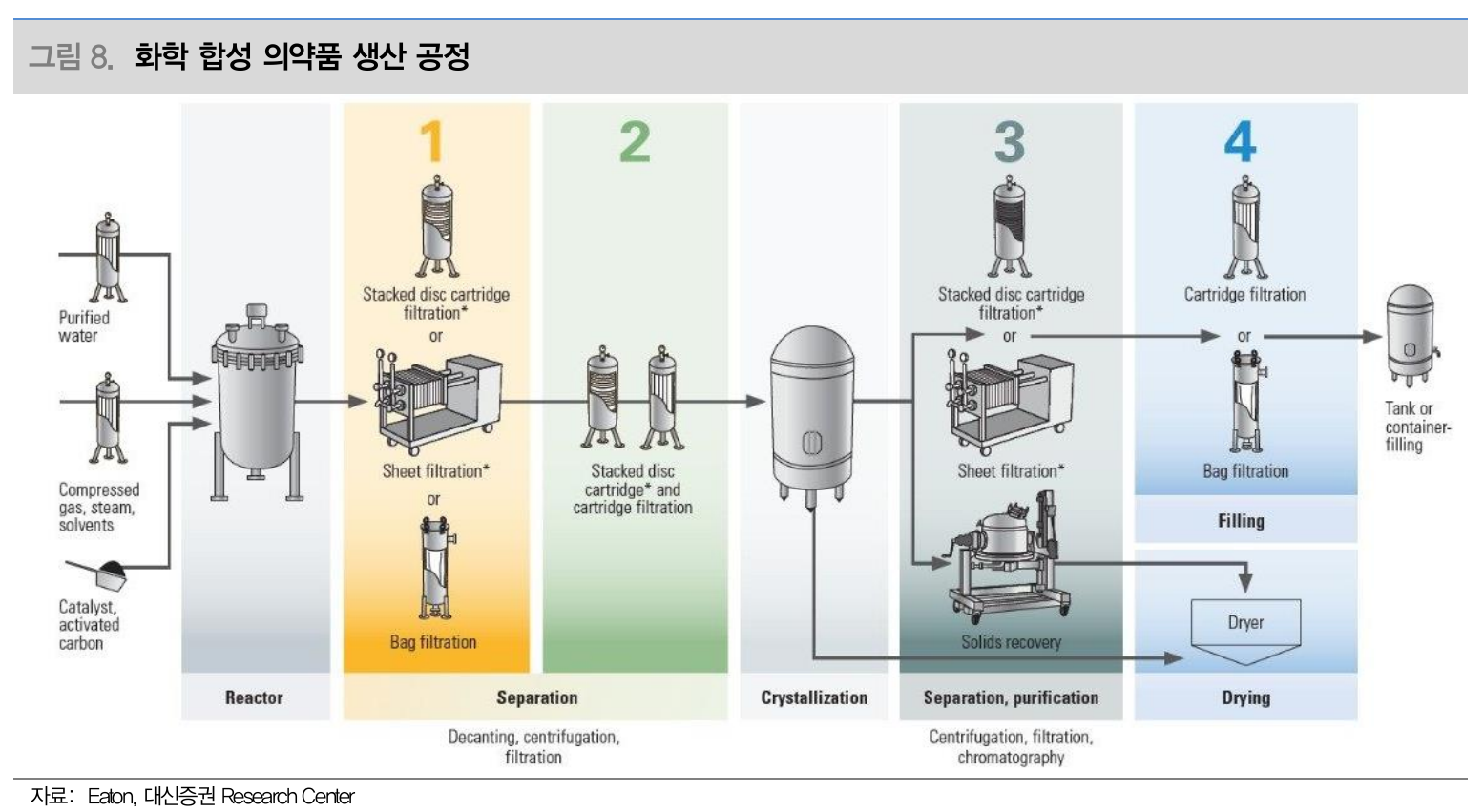
저분자 의약품
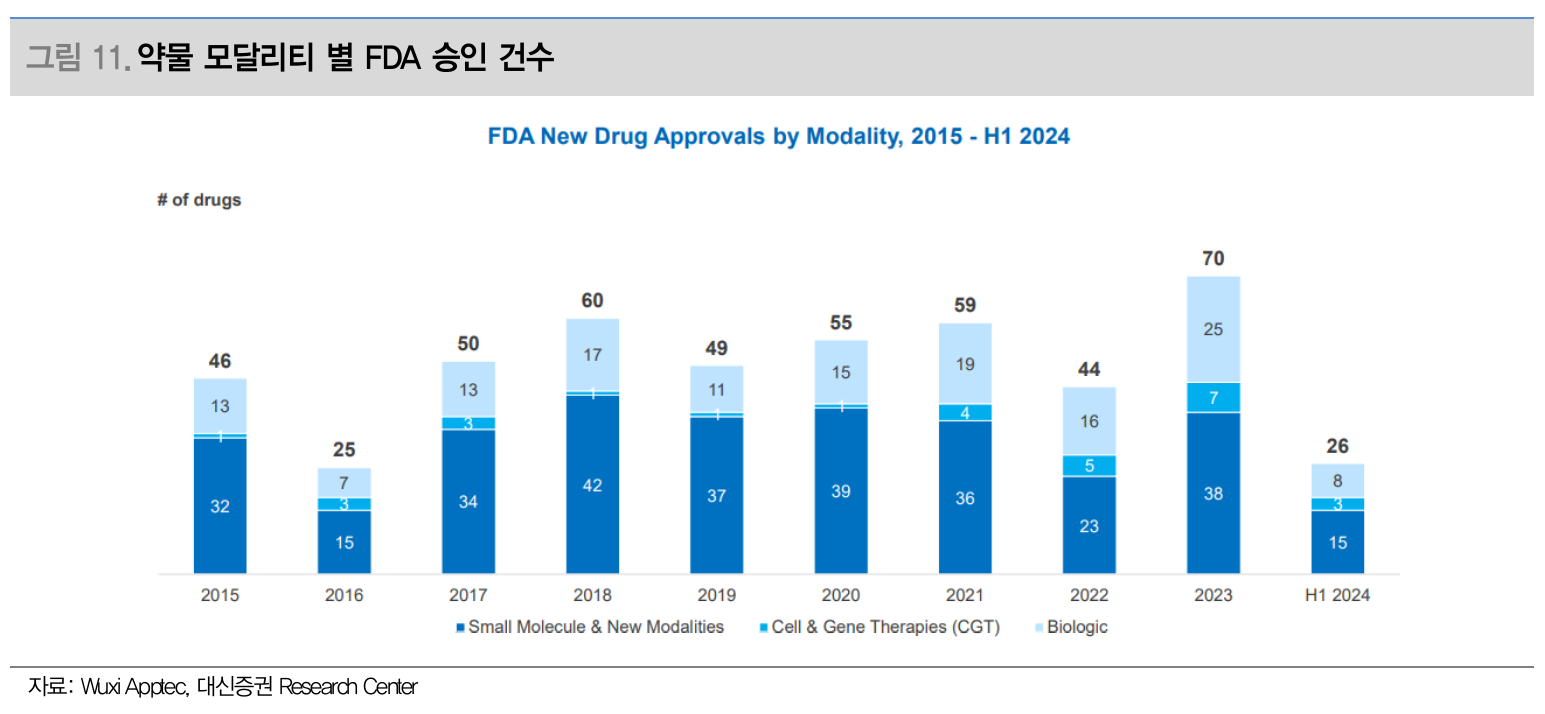
전 세계 의약품의 53%
펩타이드, ADC 링커 및 페이로드, RNA로 수요 증가 중
약물 모달리티 별 FDA 승인 건수 (Source: 대신증권)
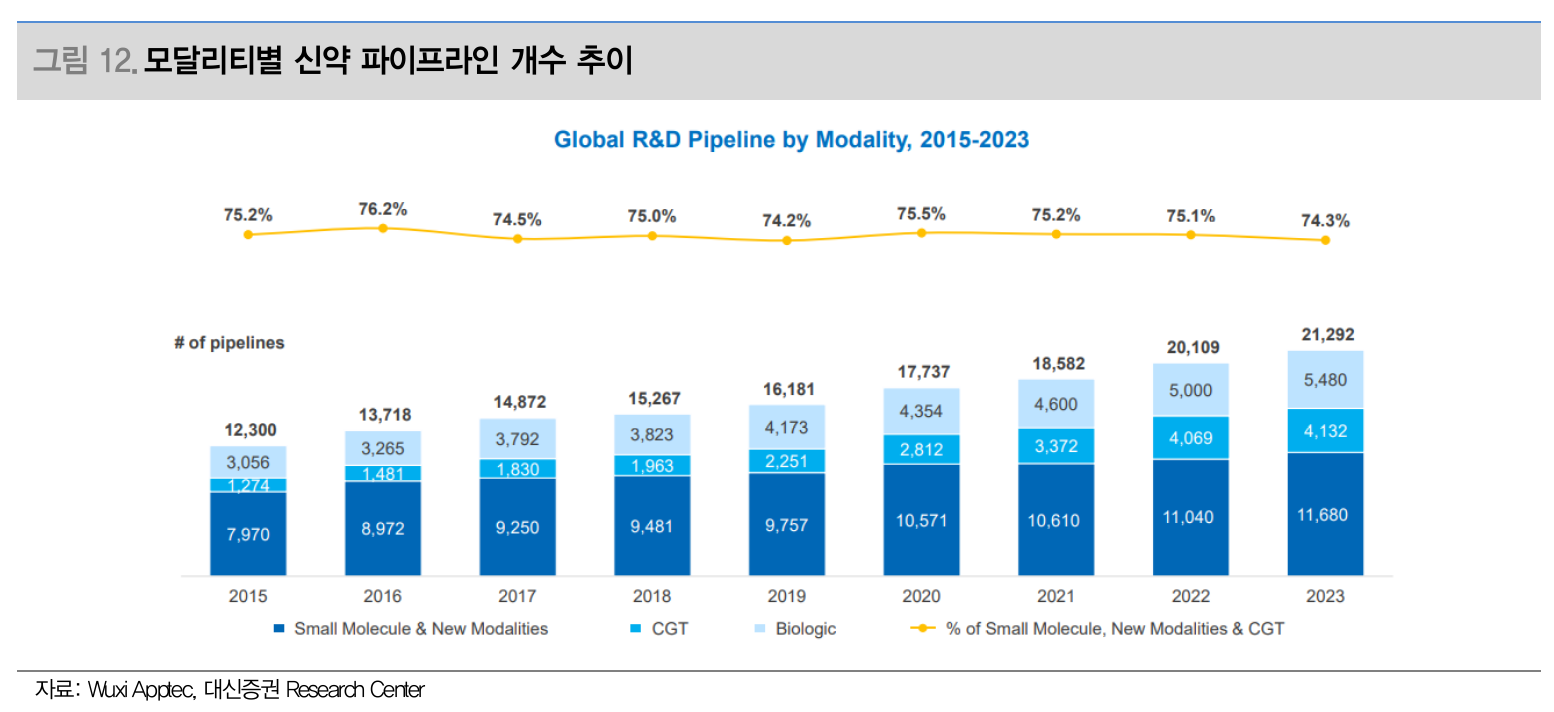
- 모달리티별 신약 파이프라인 개수 추이 (Source: 대신증권)
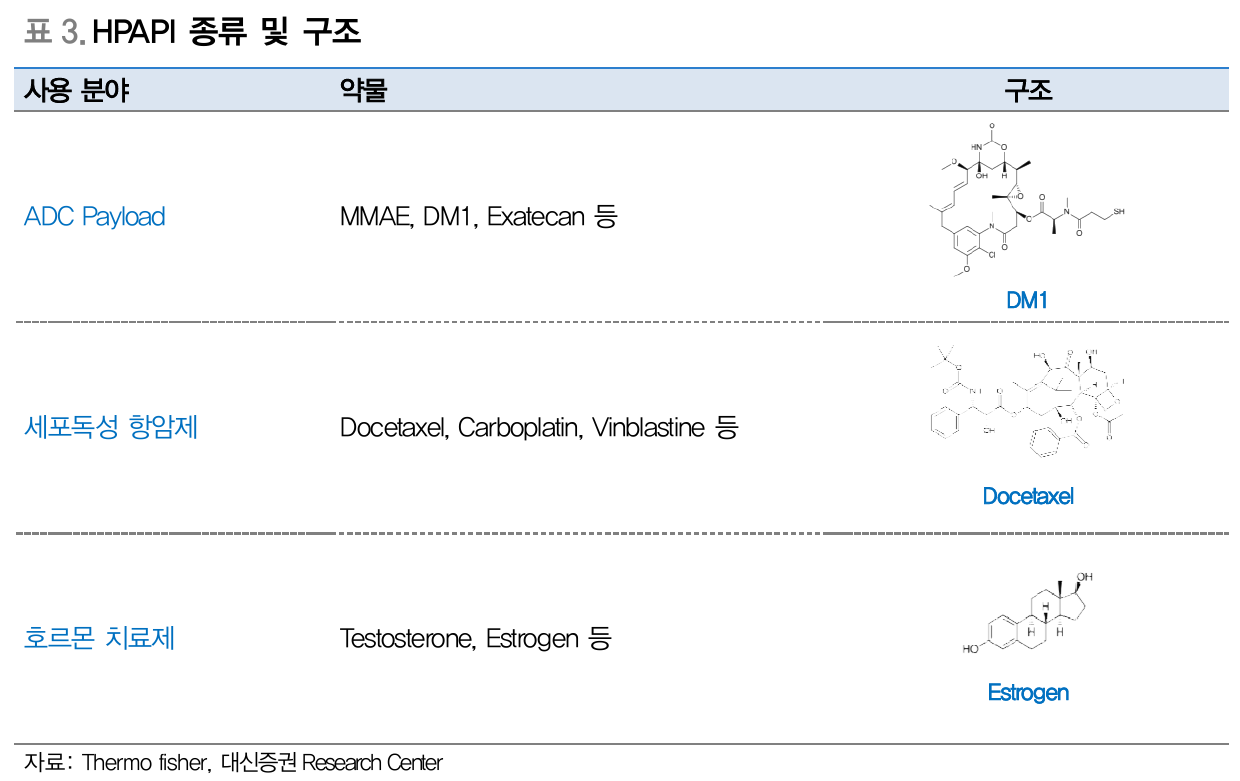
HPAPI (High Potency Active Pharmaceutical Ingredient, 고활성 원료 의약품)
체중 1kg 당 150 마이크로그램 이하로도 활성을 나타내는 원료의약품
부작용은 줄이면서 치료 효율 극대화
항암제 쪽에서 수요 올라가고 있음
- ADC payload로 사용됨
극소량 노출 만으로도 인체에 해롭기 때문에 생산 및 취급 과정에서 엄격한 안전관리 요구
HPAPI 제조 시설은 세제곱미터 당 1 마이크로그램 미만 OEL (Occupational Exposure Limit) 유지해야 함
공기 중 노출을 철저히 제어할 수 있는 고도로 밀폐된 환경을 갖춰야 함
HPAPI 종류 및 구조 (Source: 대신증권)
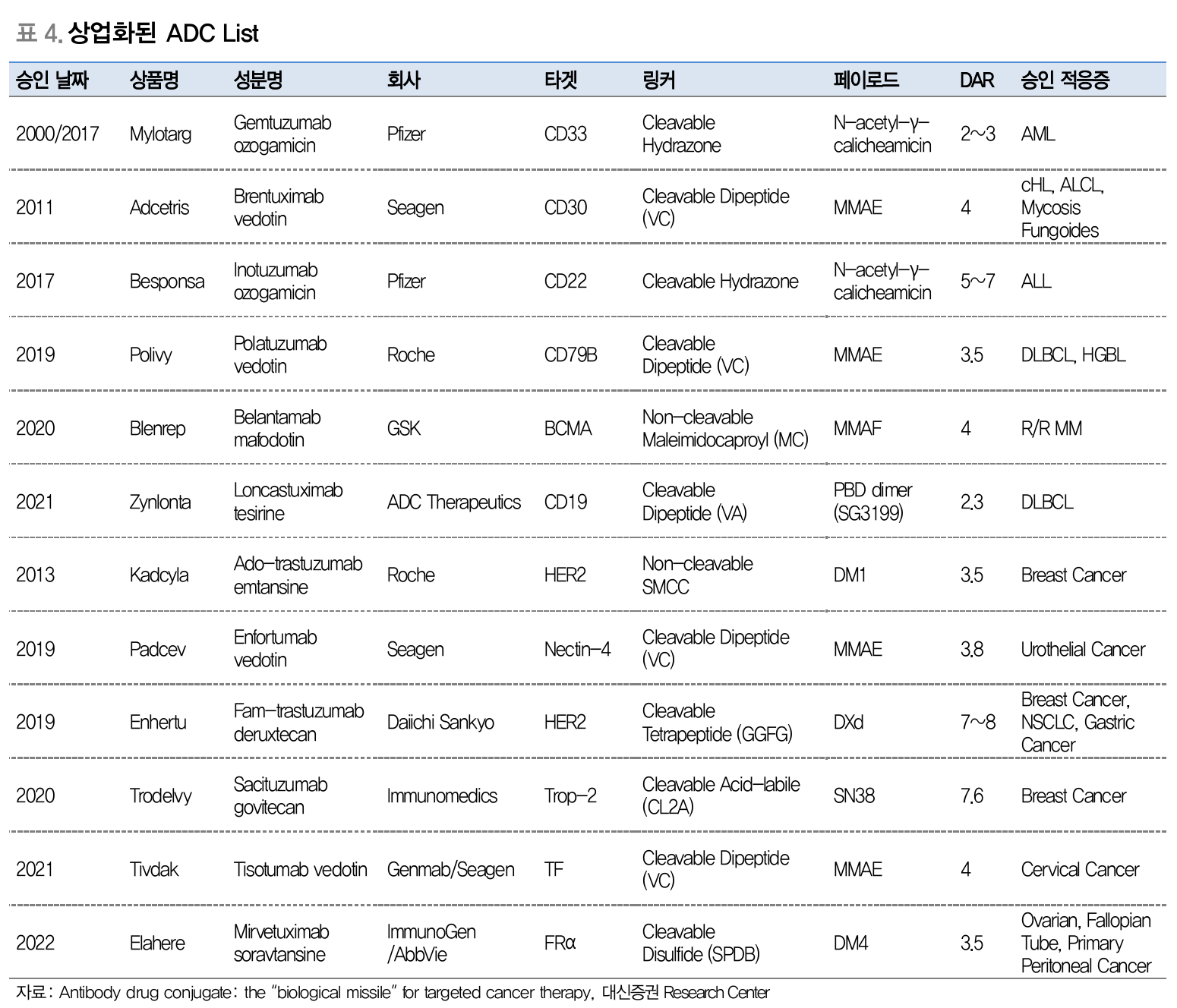
ADC (Antibody Drug Conjugate) Linker & Payload
저분자 의약품은 선택성이 낮아서 정상 세포에도 부작용을 일으킬 수 있음
특정 항원에 선택성이 높은 항체에 저분자 약물을 결합한 ADC 개발이 활발히 진행 중
항체의 표적화 기능과 저분자 화합물의 세포독성을 결합한 형태
항체, 링커, 페이로드 (세포독성 약물)로 구성
항체를 제외한 링커와 페이로드의 생산 및 결합 과정인 conjugation은 모두 화학반응으로 이루어짐
현재까지 승인된 ADC 페이로드 대부분은 적은 양으로도 강력한 세포독성을 발휘 - HPAPI로 분류
전용 HPAPI 시설에서만 생산 가능
상업화된 ADC list (Source: 대신증권)
Oligonucleotide
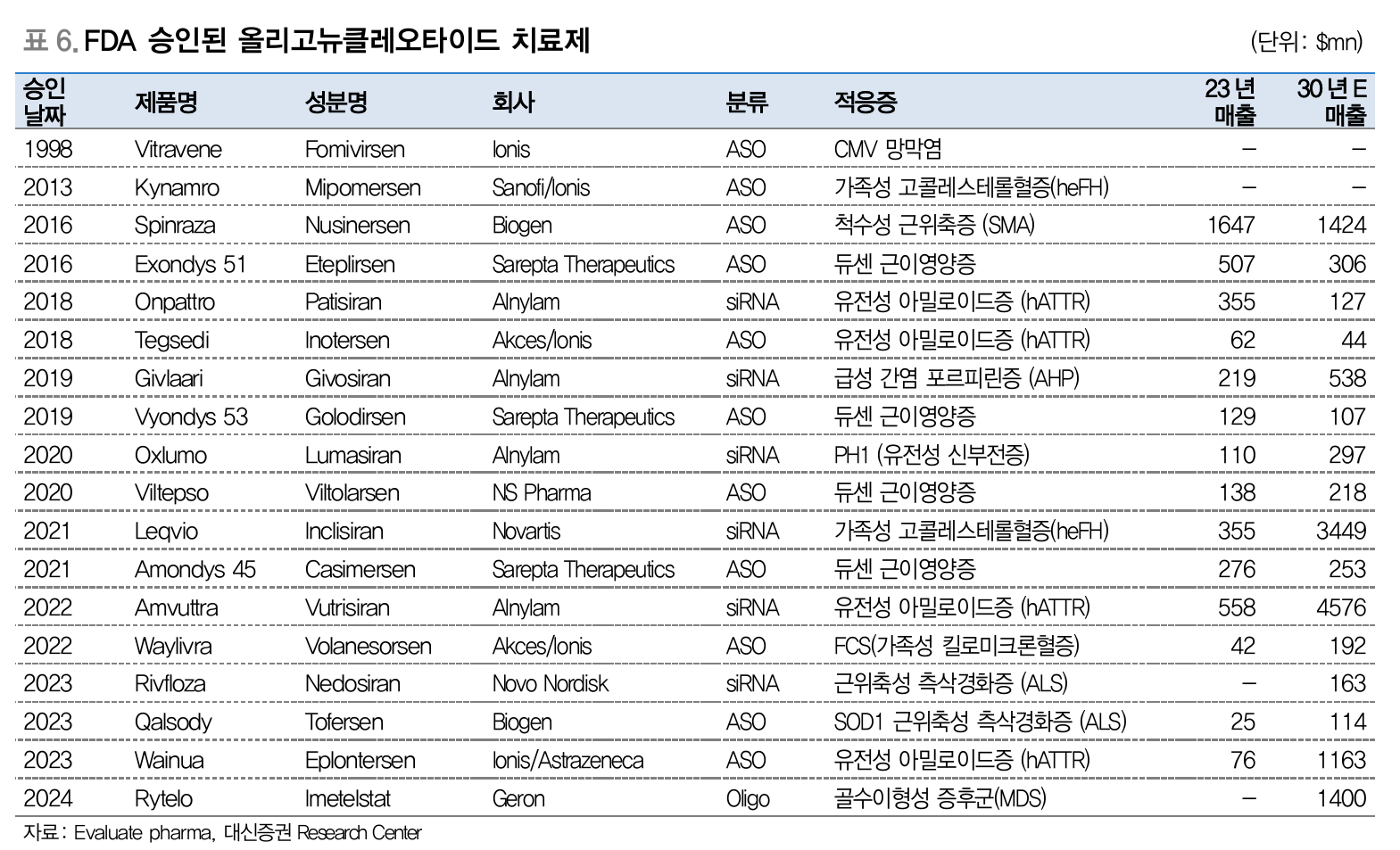
특정 유전자의 발현을 조절하거나 억제할 수 있는 짧은 DNA, RNA 서열로 구성된 치료제
희귀 유전질환 치료를 목적으로 개발됨
작용 기전에 따라 ASO (Antisense Oligonucleotide), RNAi (RNA interference)로 분류
특정 유전자를 표적으로 하여 질병의 근본 원인을 차단
고체상 합성법을 통해 생산
- Nucleoside를 하나씩 추가해서 복잡한 서열을 순차적으로 연결
- 반응 중간에 고체 지지체에 결합되어 있어 불필요한 부산물이나 미반응 물질 제거가 쉬움 → 정제 과정이 간단하고 합성 효율 극대화
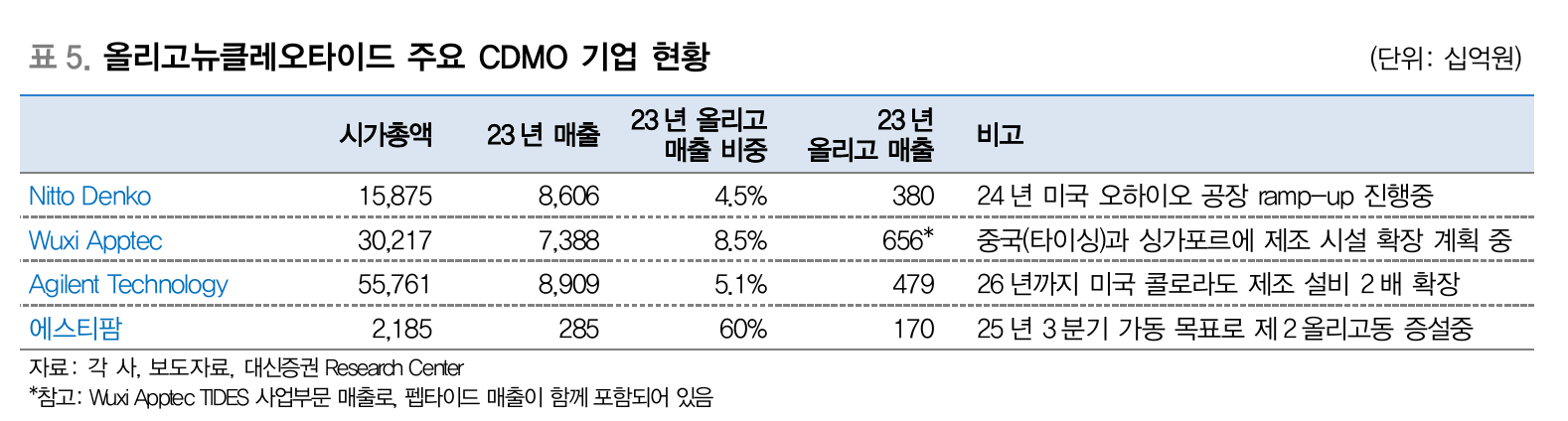
기존 API나 HPAPI를 생산하던 기업들은 이미 높은 수준의 화학 합성 기술과 품질관리 시스템이 있어서 oligonucleotide 생산에서도 경쟁우위가 있을 것
올리고뉴클레오타이드 주요 CDMO 기업 현황 (Source: 대신증권)
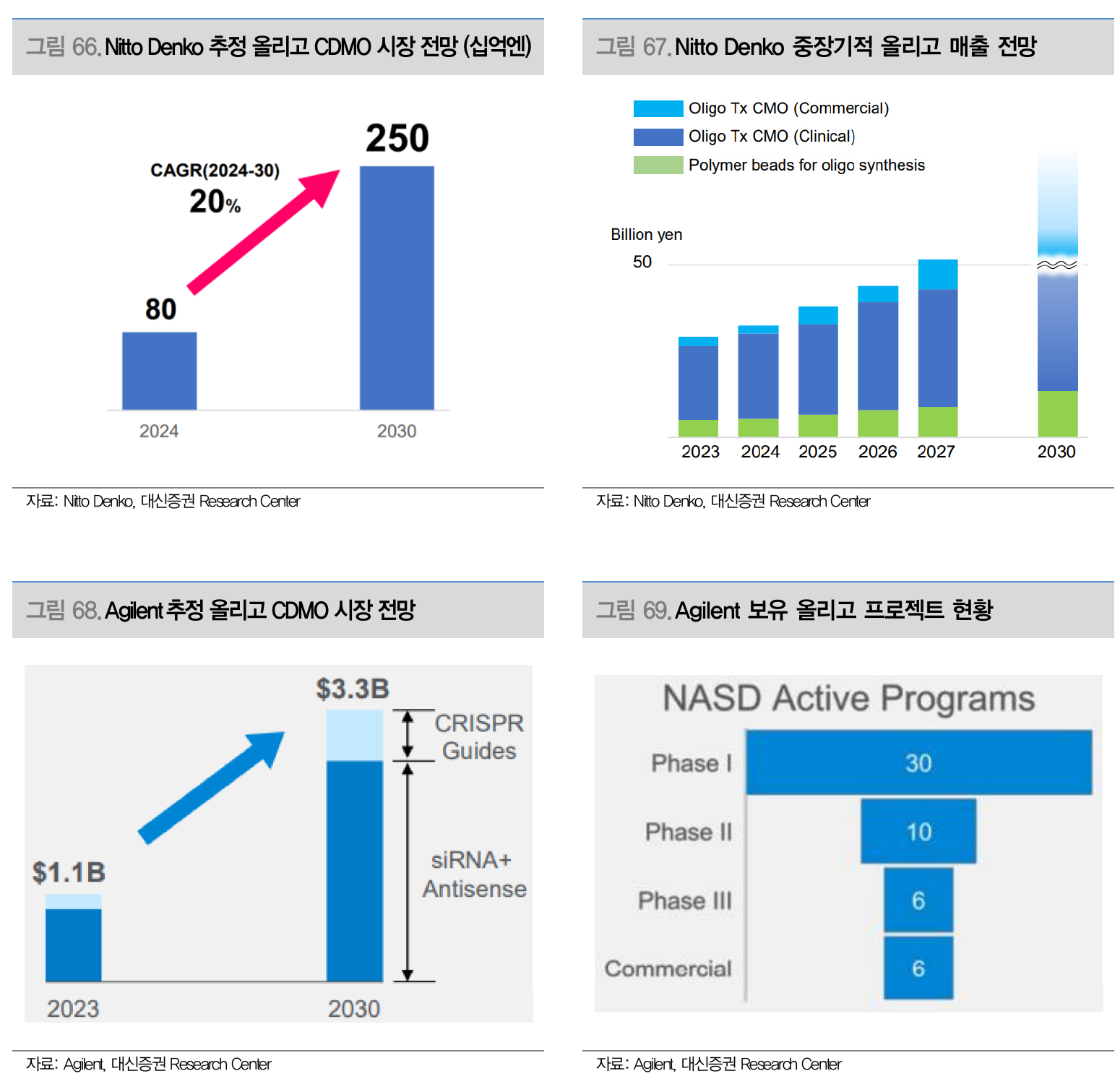
- 올리고뉴클레오타이드 주요 CDMO 기업 시장 전망 (Source: 대신증권)
- FDA 승인된 올리고뉴클레오타이드 치료제 (Source: 대신증권)
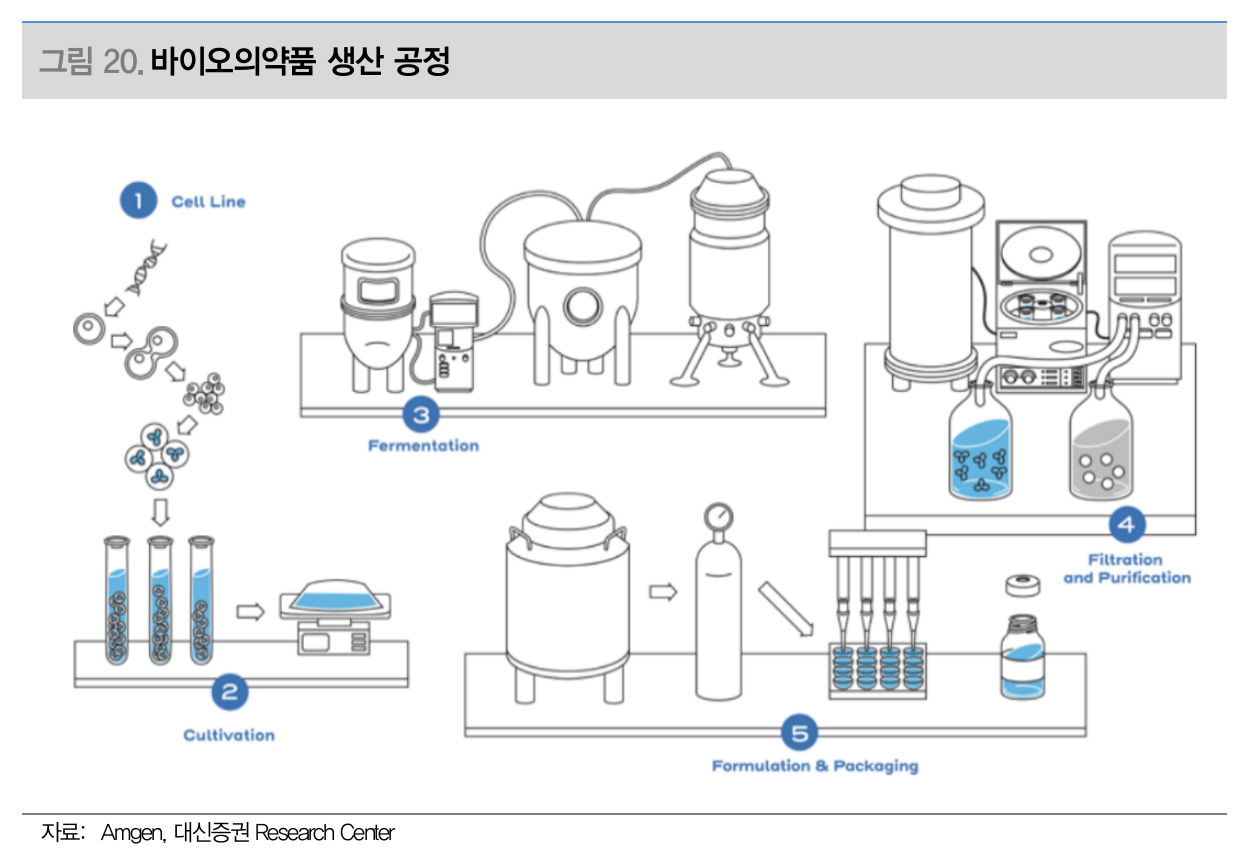
바이오 의약품 생산
- 무균 환경 유지 및 정밀한 온도, pH 조절 필수 - 초기 투자비용 높음
- 복잡한 공정으로 생산 시간도 길고 효율도 낮음
- 시설 운영 및 관리가 합성의약품 생산시설에 비해 까다롭고, 유지관리 비용도 비쌈
Antibody drug (항체 의약품)
동물 세포 (Mammalian Cell) 배양을 통해 생산
- 인간 단백질과 유사한 형태의 단백질을 생산
- 시간이 많이 걸리고 관리 비용이 높아 생산 비용이 높음
- 정확한 온도, pH, 산소 농도 유지, 감염에 취약해서 클린룸/멸균 처리 시스템 필요
생산공정
- 세포 배양
- 단백질 생성 및 분비
- 정제 및 여과
- Formulation
장비
- 바이오리액터
- 무균처리장비
전체 바이오 의약품 시장의 50%
바이오의약품 생산 공정 (Source: 대신증권)
ADC
- Antibody, linker, payload, conjugation 전부 생산 가능 기업
- Lonza, Wuxi Apptec, Merck KGaA
- Fujifilm
- ADC end-to-end 시설 증설 중 - 2026년 가동 목표
- ADC는 항체 생산 및 화합 합성이 모두 필요
- 국내 대형 CDMO는 conjugation (약물 결합)부터 시작
- 주요 글로벌 ADC CDMO 기업별 생산 가능 부분 (Source: 대신증권)

- 의약품 CDMO 서비스 제공 항목 (Source: 대신증권)
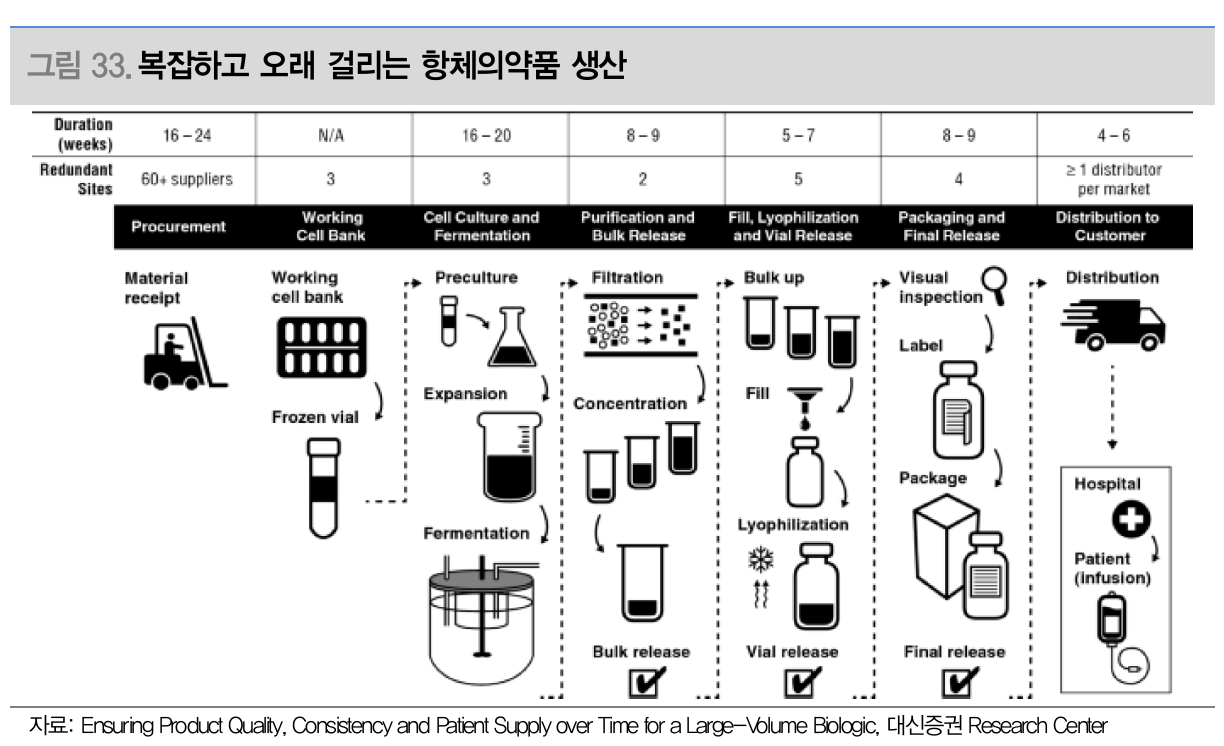
- 복잡하고 오래 걸리는 항체의약품 생산 (Source: 대신증권)
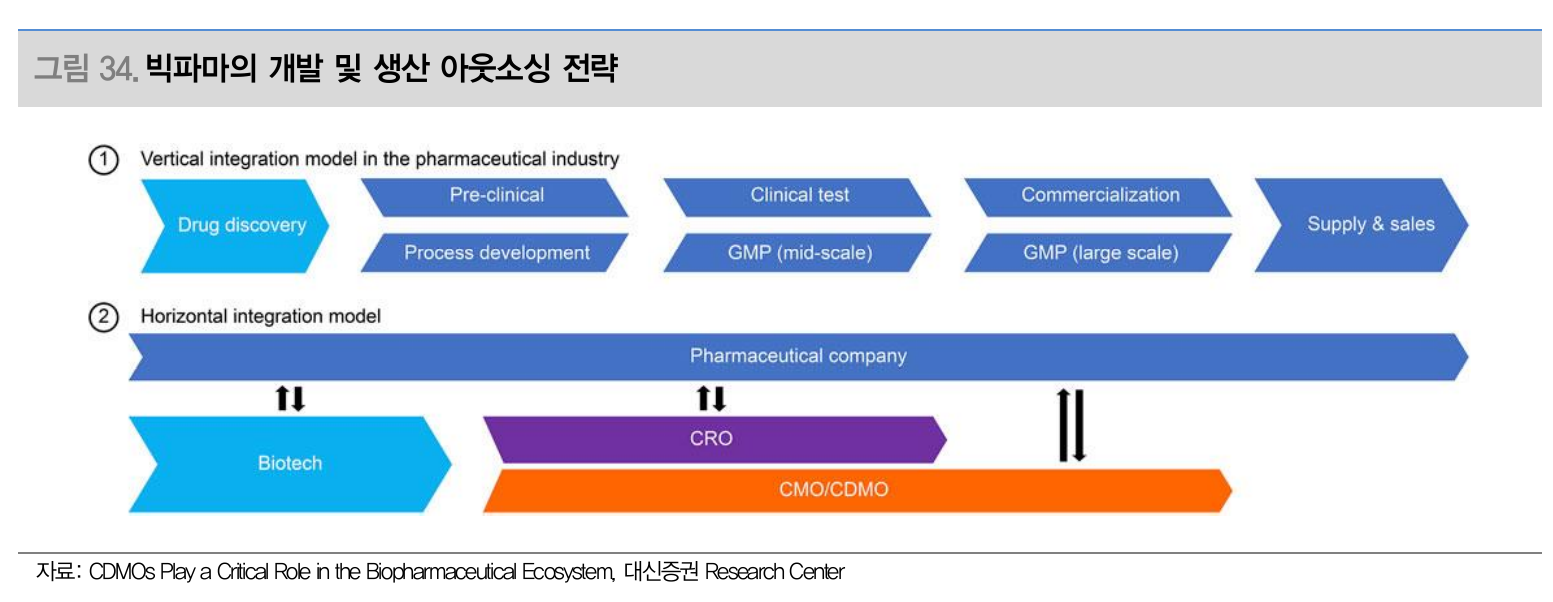
빅파마에게 CDMO 장점
- CDMO 전문성을 활용한 비용 절감 및 시간 단축
- Multi-sourcing을 통한 의약품 공급 안전성 확보
- 우수한 규제 및 품질 관리 역량으로 약물 출시 시간 단축
- 빅파마의 개발 및 생산 아웃소싱 전략 (Source: 대신증권)
BIOSECURE Act - HR 8333
2032년 이전에 체결된 계약에는 적용되지 않음
중장기적인 관점에서 국내 CDMO가 북미향 수혜를 볼 것
FDA, EMA는 신약 승인 과정에서 공급망 내 품질관리 시스템을 엄격히 규제
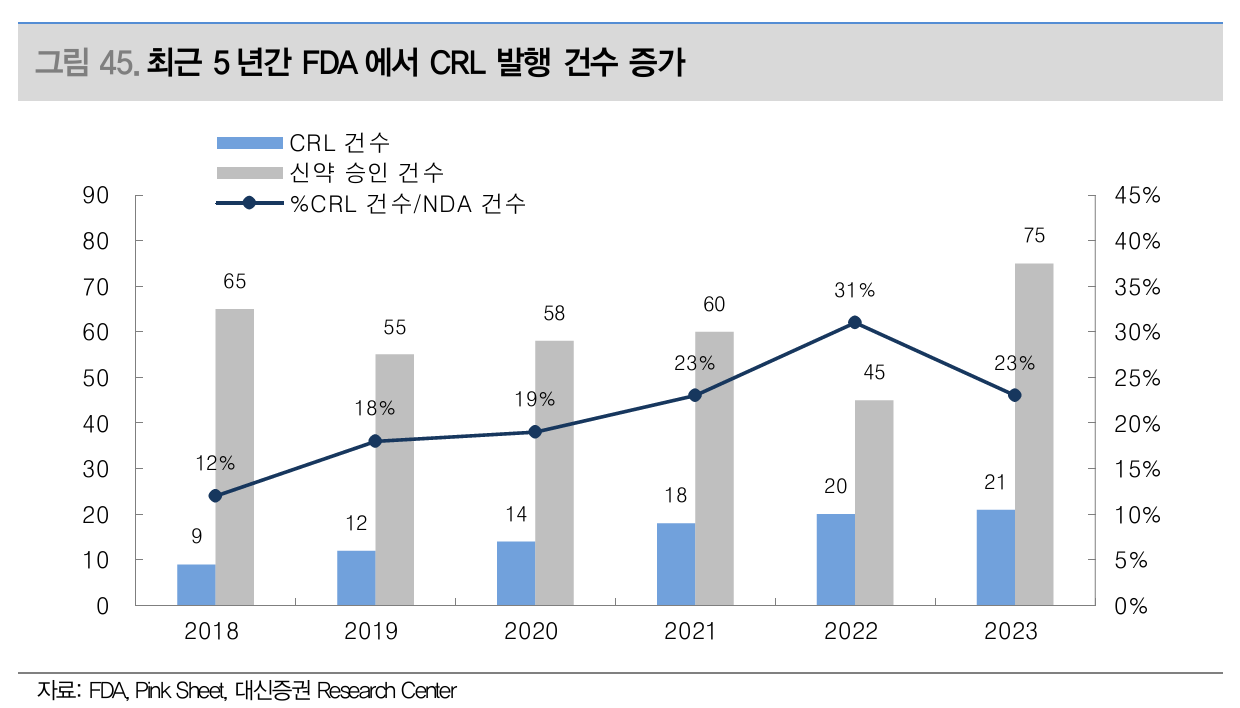
CRL (Complete Response Letter) 발행 비율이 최근 5년간 증가
- 문제 해결을 위해 최소 2-6개월 보완기간 필요 - 승인 및 출시 지연
cGMP 인증 받고 FDA 기준에 부합하는 시설을 갖춰야 중장기적 수혜를 받을 수 있을 것
최근 5년 간 FDA에서 CRL 발생 건수 증가 (Source: 대신증권)
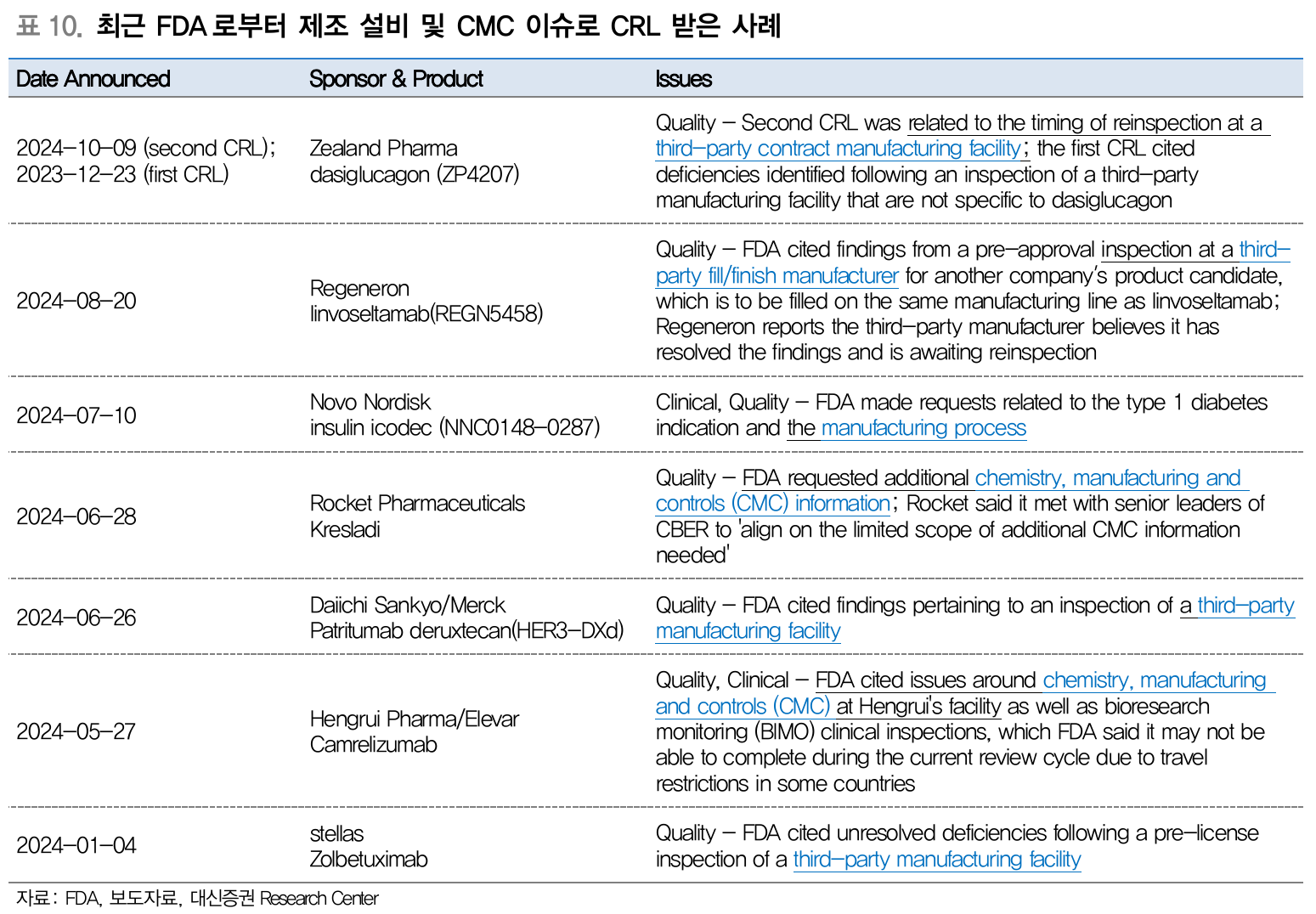
- 최근 FDA로부터 제조 설비 및 CMC 이슈로 CRL 받은 사례 (Source: 대신증권)
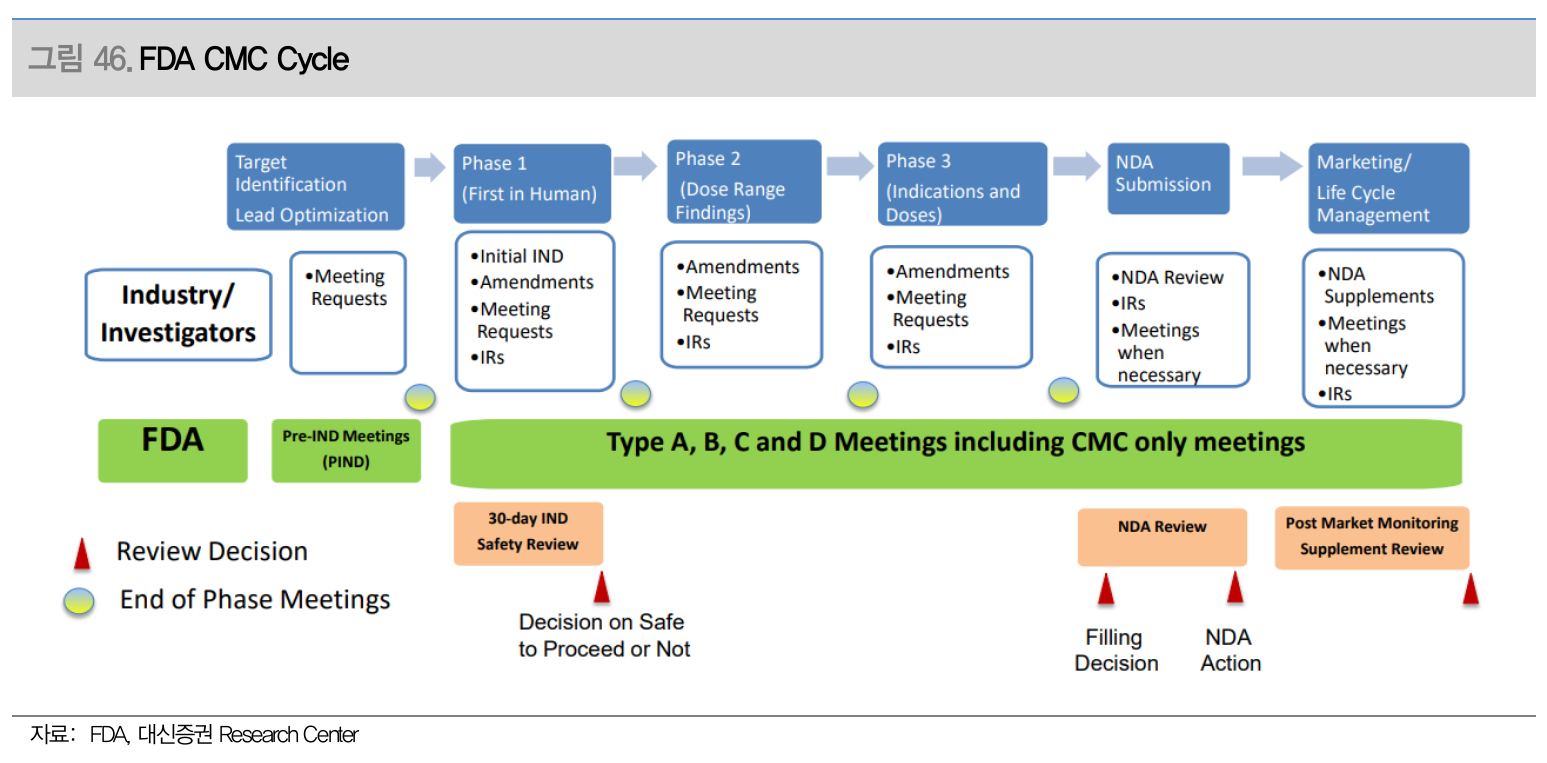
- FDA CMC Cycle (Source: 대신증권)
CDMO 생산 난이도:
화학합성 (저분자 의약품, RNA, 펩타이드 등) < 바이오의약품 (HPAPI, Oligonucleotide, ADC 등)
ADC: Conjugation < linker, payload < antibody
바이오의약품 생산 가능한 CDMO는 난이도가 낮고 요구조건이 상대적으로 덜 까다로운 화학합성 CDMO도 가능하나…
사실상 전환이 가능하다고 보는건 무리
- 공산품 만드는 공장도 제품 라인을 바꾸는건데…
- FDA 승인을 길면 5년을 기다려야 되는 승인을 받아야만 하는 공정이 휙휙 전환이 가능할리가 없음
- 인력도 완전히 구성이 다를 것
Pharmaceuticals 보면서 항상 느끼는거지만, 같은 산업에 묶이지만 분야를 넘나들면서 경쟁하지 않음
- 산업을 쪼개서 보면 공수를 덜 수 있음
- 제약 산업 리서치를 한다고 하면, 전부 다 볼필요는 없으나 항암제는 뒤지게 어렵다
- Rare disease도 대체 어떤 식으로 돈을 버는지 이해가 안됨
- 전 세계에서 환자 1000명도 안되는데 시총 30조도 가능
References
- 2025년 CDMO는 맑음 (2024-10-29, 대신증권)
Disclaimer!
- 본 게시물은 단순 의견 및 기록 목적으로 작성되었으며 특정 투자상품의 매수·매도·보유 등 투자 권유를 의미하지 않습니다
- 본 게시물은 작성자 개인의 판단에 근거하여 작성되었고, 작성자 본인이 속한 기관의 의견을 대변하지 않습니다
- 본 게시물은 작성자 본인이 작성일 시점에 신뢰할 만하다고 판단하는 자료와 정보에 근거하였으나, 정확성이나 완전성, 신뢰성을 보장하지 않습니다
- 본 게시물은 그 어떠한 경우에도 증권, 파생상품 등 금융투자상품에 대한 투자조언으로 해석될 수 없습니다
- 본 게시물은 투자자의 투자 결과에 대해 어떠한 목적의 증빙자료로도 사용될 수 없습니다
- 본 게시물을 이용함으로써 발생하는 직·간접적 손실에 대해 어떠한 책임도 지지 않습니다